Lipazy są hydrolazami działającymi na występujące w TAG wiązanie estrowe uwalniające kwasy tłuszczowe i glicerol. Reakcja katalitycznej hydrolizy estrów triacylogliceroli przebiega w dwóch etapach: acylacji i deacylacji [67;34].
Reakcja rozpoczyna się atakiem atomu tlenu grupy hydroksylowej, serynowej reszty nukleofilowej na aktywowany atom węgla grupy karbonylowej wiązania estrowego TAG (rys.4). Zostaje utworzony pierwszy, krótkotrwały, tetraedryczny produkt pośredni o ujemnie naładowanym atomie tlenu grupy karbonylowej oraz czterech atomach związanych z atomem węgla grupy karbonylowej rozmieszczonych jako tetraedr. Produkt pośredni jest stabilizowany przez makrodipolową helisę C i wiązania wodorowe pomiędzy ujemnie naładowanym atomem węgla grupy karbonylowej (tzw. oxyanionem) oraz co najmniej dwoma grupami NH głównych łańcuchów (tzw. luki oxyanionu) (rys.5). Jedna z grup NH pochodzi z reszty leżącej za nukleofilową seryną, natomiast druga z reszty leżącej na końcu pasma β 3. Nukleofilowość atakującej seryny jest powiększona przez katalityczną histydynę, na którą przenoszony jest proton z grupy hydroksylowej seryny. Z kolei przeniesienie protonu jest ułatwione dzięki obecności kwasu katalitycznego, który precyzyjnie orientuje pierścień imidiazolowy histydyny i częściowo neutralizuje atak na swoje grupy.
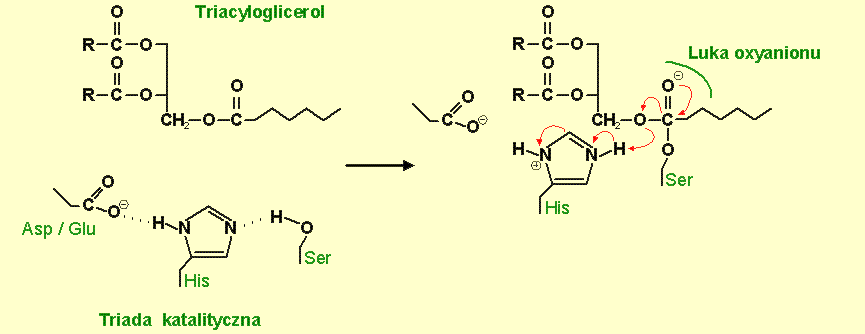
Rys.4 Aktywacja nukleofilowej reszty seryny (Ser) przez sąsiadującą histydynę (His) oraz nukleofilowy atak atomu O- seryny na atom węgla grupy karbonylowej wiązania estrowego TAG.
Następnie proton jest przekazywany na tlen wiązania estrowego, które w ten sposób staje się rozszczepialne. Rozszczepienie wiązania substrat-ester, rozkład produktu pośredniego i protonacja prowadzą do dysocjacji DAG z wytworzeniem acyloenzymu (rys.5) [67]. Na tym etapie kwasowy komponent substratu jest zestryfikowany z nukleofilową seryną ("kowalencyjny produkt pośredni"), podczas gdy komponent alkoholowy dyfunduje.
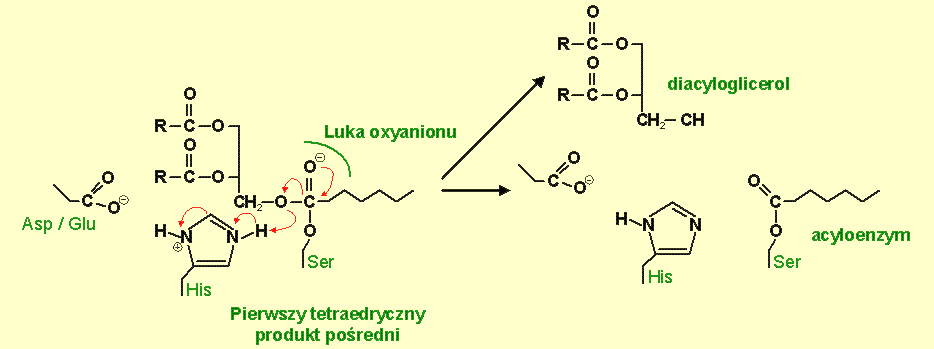
Rys.5 Powstanie pierwszego tetraedrycznego produktu pośredniego, stabilizowanego dwoma peptydowymi grupami NH. Histydyna (His) przekazuje proton na dyfundujący komponent alkoholowy.
Następnym krokiem jest etap deacylacji, w którym cząsteczka wody hydrolizuje kowalencyjny produkt pośredni. Miejsce aktywne histydyny działa na cząsteczkę wody przez "wyciągnięcie" z niej protonu (atomu wodoru). W rezultacie jon OH- atakuje atom węgla grupy karbonylowej w acylowej grupie kowalencyjnie związanej z seryną. Ponownie dochodzi do utworzenia krótkotrwałego, ujemnie naładowanego, tetraedrycznego produktu pośredniego, który jest stabilizowany przez interakcje z luką oxyanionu [34].
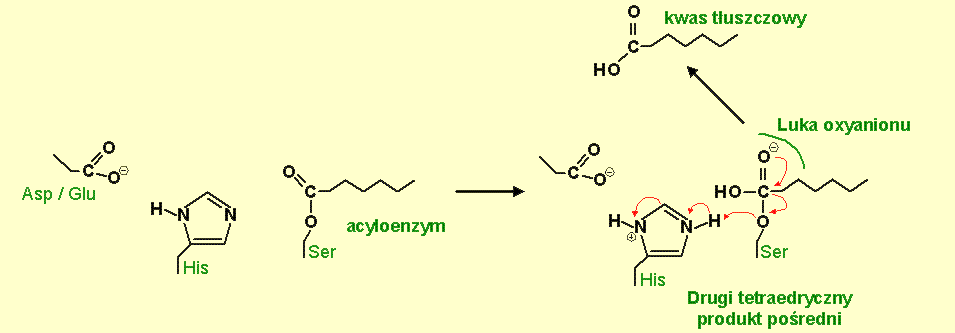
Rys.6 Kowalencyjny produkt pośredni ("acyloenzym"), w którym został zestryfikowany kwasowy komponent substratu z resztą seryny enzymu. Reszta histydyny (His) aktywuje cząsteczkę wody.
Histydyna przekazuje proton na atom tlenu aktywnej reszty seryny, która następnie uwalnia acylowy komponent. Po dyfuzji kwasu tłuszczowego enzym jest gotowy do kolejnego cyklu katalitycznego.
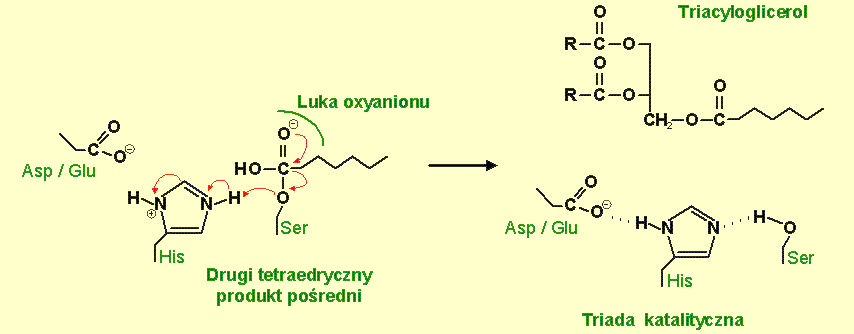
Rys.7 Reszta histydyny (His) przekazuje proton na atom tlenu aktywnej reszty seryny (Ser), rozszczepieniu ulega wiązanie pomiędzy seryną, a komponentem arylowym, uwolniony zostaje produkt arylowy.
Przestrzenne rozmieszczenie triady umożliwia serynie lub cząsteczce wody wykonać nukleofilowy atak na grupę karbonylową, odpowiednio substratu lub acylo-enzymu. Kiedy lipaza działa w środowisku niskiej aktywności wodnej, nukleofile inne niż woda (np. alkohole, aminy) mogą pełnić funkcję ostatecznego akceptora grupy acylowej w reakcjach przenoszenia grup arylowych katalizowanych przez lipazy [12;67].
Dowody potwierdzające ten mechanizm katalizy pochodzą z różnych badań, szczególnie z wiązania inhibitorem lipaz i analizy strukturalnej powstałych kompleksów enzym-inhibitor. Dodatkowo analiza krystalograficzna reakcji katalizowanej przez dehalogenazę haloalkanową (innego enzymu o α/β fałdowaniu hydrolaz), dostarczyła definitywnego dowodu na występowanie kowalencyjnego produktu pośredniego.