Gdy poznano struktury pierwszych lipaz, okazało się, że prezentują one podobne cechy drugorzędowej struktury w przeciwieństwie do znaczących różnic w sekwencjach aminokwasowych. Wszystkie lipazy, które zostały dotychczas opisane fałdują się z podobny sposób i posiadają pokrywającą się topologię reszt triady katalitycznej oraz potencjalną lukę oxyanionu [62]. Ollis i współpracownicy [50] nazwali ten model fałdowania jako α/β fałdowanie hydrolaz (rys.2). Zostało ono zidentyfikowane nie tylko dla lipaz i esteraz, ale również dla innych hydrolitycznych enzymów posiadających katalityczną triadę, włączając karboksypeptydazę serynową z pszenicy (Ser-Asp-His), hydrolazę dienolaktonu Pseudomonas sp. B13 (Cys-Asp-His), dehalogenazę haloalkanową Xanthobacter autothropicus (Asp-Asp-His), kutynazę Fusarium solani pisi (Ser-Asp-His), oraz tioesterazę Vibrio harveyi (Ser-Asp-His) [67;74].
Kanoniczne α/β fałdowanie hydrolaz składa się, głównie z równoległych β - kartek ośmiu pasm z drugim pasmem β 2 przeciwrównoległym. Równoległe pasma od β 3 do β 8 są połączone α - helisami, które ułożone są po drugiej stronie centralnej β - kartki. β - kartka posiada lewo-skrętny superhelikalny twist, taki, że powierzchnia kartki przykrywa około połowę cylindra oraz pierwsze i ostatnie pasmo skrzyżowane ze sobą pod kątem ~90°. Wykrzywienie β -kartki może się różnić znacząco wśród różnych enzymów, a również przestrzenne pozycje topologicznie ekwiwalentnych α - helis mogą się znacznie zmieniać. Odchylenia łańcucha peptydowego na C - końcowych zakończeniach pasm w C - końcowej połowie β - kartki tworzą wiążące subdomeny α/β fałdowania hydrolaz. Różnią się one znacząco w długości i architekturze, zgodnie z olbrzymią rozmaitością substratów tych enzymów [67].
Szczegółowy przegląd α/β fałdowania hydrolaz dla lipaz został opublikowany przez Schrag & Cygler [50]. Struktury lipaz bakteryjnych poznane dotychczas odpowiadają α/β fałdowaniu hydrolaz z pewnymi drobnymi różnicami. Lipazy pochodzące od Bacillus glumae (GBL), Bacillus cepacia (BCL) i Chromobacterium viscosum (CVL) posiadają sześć równoległych β pasm w centralnej β - kartce α/β fałdowania hydrolaz (od β 3 do β 8). Karboksyesteraza Pseudomonas fluorescens zawiera siedem pasm, odpowiadających pasmom od β 2 do β 8 kanonicznej fałdy, a lipaza Streptomyces exfoliatus (SEL) posiada pełne kanoniczne α/β fałdowanie hydrolaz z jednym dodatkowym przeciwrównoległym β pasmem dodanym jako pasmo 9. Jednakże, oczekuje się, że dalsze badania nad strukturami lipaz przyniosą odkrycia większych odchyleń, na przykład mniejszych lipaz u Bacillus i tioesteraz u Escherichia coli, oraz lipaz o wyższej masie molekularnej pochodzących od gatunków Staphylococcus [62;74].
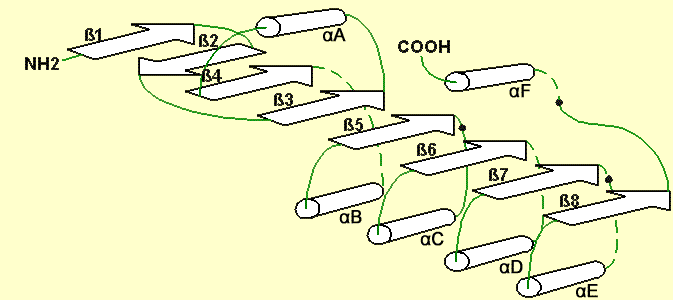
Rys.2 Kanoniczne α/β fałdowanie hydrolaz. α helisy zostały zobrazowane cylindrami; β pasma - strzałkami, natomiast topologiczne pozycje reszt katalitycznych miejsca aktywnego - czarnymi punktami [33].