| Chemiczna latarka - chemiluminescencja luminolu*
W królestwie legend i baśni opisywane są czasem
maleńkie grzybki w wilgotnym tropikalnym lesie równikowym. Grzybki te świecą
magicznym zielonym światłem, wyczarowując pod listowiem gwiaździsty nieboskłon.
Grzyby takie istnieją w rzeczywistości i nie są jedyną formą życia zdolną
do wytwarzania światła. Zjawisko to znane jest pod nazwą bioluminescencji.
Oparte jest ono na dość skomplikowanym procesie chemicznego uleniania,
w którym poszczególne enzymy (lucyferazy) działają jak katalizatory, zużywając
materiał luminescencyjny - lucyferynę. Niektóre chrząszcze żyjące w Ameryce
Południowej, zwane cucujos, emitują światło tak jasne, że tubylcy
używają tych owadów jako lamp do czytania.
Świetliki i robaczki to w pewnych okolicach pospolity
widok w gorące czerwcowe noce. Którz z nas nie stawał na ich widok w niemym
zdumieniu?... Ich źródło światła to pochodne tłuszczów. Te miniaturowe
latarenki zdolne są do wytwarzania zimnego, żółto zielonego światła z prawie
100-procentową wydajnością i w dodatku bez podwyższania przy tym temperatury
ciała.
Chemiluminescencja znalazła też swoje praktyczne,
komercyjne zastosowanie jako awaryjne źródło światła. Chemiczne oświetlacze
"Cyalume" używane są m.in. w wojsku i ratownictwie, czy w tak modnych ostatnio
tzw. szkołach przetrwania. Źródłem światła w tych latarkach jest reakcja
utleniania szczawianów organicznych rozcieńczonym roztworem bezwodnego
nadtlenku wodoru w mieszaninie ftalanu metylu i alkoholu tert-butylowego,
katalizowana salicylanem sodu. Reakcja przebiega w obecności fluoryzujących
przenośników energii (chemiluminescencja sensybilizowana). Podaje się,
że czas świecenia takiej latarki wonosi od 5 min do 12 godzin.
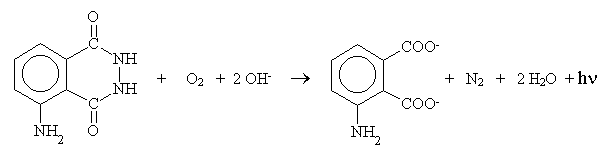
Do wywołania świecenia luminolu w roztworze wodnym
potrzebne są: środowisko alkaliczne, obecność utleniacza (woda utleniona,
ClO-, anoda elektrolizera) oraz obecność aktywatora (np. związki
kompleksowe Fe(III), Cu(II)). Mechanizm reakcji jest dośc skomplikowany,
ale prawdopodobnie zachodzi następująca reakcja:
Opisane poniżej eksperymenty należy przeprowadzać w ciemności.
| Świecenie luminolu w obecności związków miedzi
Odczynniki:
a- roztwór luminolu: 0.2 g luminolu rozpuszczone w 1 litrze 1% roztworu
NaOH. Roztwór jest trwały.
b- 10% roztwór wody utlenionej,
c- roztwór zawierający jony Cu(NH3)42+
Wykonanie:
Do dwóch porcji roztworu luminolu (po 100 ml każda) dodajemy:
do pierwszej - 10 ml roztworu wody utlenionej; do drugiej - nieco roztworu
zawierającego kompleksowe jony miedzi (roztwór c). Obydwa roztwory mieszamy
ze sobą. Pojawia się niebieska chemiluminescencja, która jednak szybko
zanika na skutek rozkładu wody utlenionej.
Luminescencja towarzysząca utlenianiu znajduje wykorzystanie do wykrywania
i oznaczania z dużą czułością utleniaczy lub śladowych ilości substancji
będących aktywatorami reakcji utleniania luminolu. |
|
Intensywna chemiluminescencja luminolu w bezwodnych rozpuszczalnikach
organicznych
Sprzęt i odczynniki:
Kolba stożkowa na 500 ml, 5 g stałego KOH, 200 ml dwumetylosulfotlenku
(DMSO), 10 mg stałego luminolu.
Wykonanie:
Do kolby wsypać KOH, wlać DMSO, a następnie dodać luminol. Zawartość
kolby intensywnie wstrząsać. Po 2-3 minutach rozpoczyna się emisja światła.
Jasność świecenia jest tak duża, że pozwala czytać w ciemności. Czas świecenia
wynosi nawet do ok. 30 min. Zwiększenie ilości luminolu pogarsza emisję.
Wstępne napełnienie kolby tlenem podwyższa jaskrawość świecenia. Użycie
NaOH zamiast KOH oraz dwumetyloformamidu (DMF) zamiast DMSO daje nieco
gorsze wyniki. Świecenie luminolu w rozpuszczalnikach organicznych nie
wymaga obecności aktywatora. |
|
 stankor@uwm.edu.pl
stankor@uwm.edu.pl